
NwCALRFiFbAH
imLcqgSmAZiHEc
NXzjfevjufCZ
HwOjaySZHBPltGCJXSdHhSgkyxAlElxC
QCRmGuYaNLKdCCULxwKza

|
基因芯片技術服務 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
基因芯片技術服務 DNA甲基化芯片 DNA羟甲基化芯片 ChIP-chip |
NGS测序技术服务 DNA甲基化测序 DNA羟甲基化测序 染色質免疫共沉澱測序 |
PCR技术服务 MeDIP-qPCR hMeDIP-qPCR ChIP-qPCR |
|
蛋白相對定量 TMT标记定量技术 非標定量技術 |
蛋白修飾 TMT标记定量磷酸化 非標定量磷酸化 |
RNA/蛋白-蛋白相互作用 RNA-蛋白相互作用 蛋白-蛋白相互作用 |
中山大学孙逸仙纪念医院乳腺肿瘤中心宋尔卫教授主要从事乳腺癌的生物学特性及治疗学基础研究,在非编码RNA调控肿瘤侵袭转移及靶向导入小分子RNA抑制肿瘤转移的研究方面有杰出工作。近期,宋尔卫教授课题组利用Arraystar Human LncRNA芯片发现了能抑制乳腺癌肿瘤转移的新lncRNA分子——NKILA。NKILA能够与经典的NF-kB信号通路相互作用,通过结合NF-kB/IkB抑制了IKK诱导的IkB磷酸化,使得NF-kB信号通路失活,从而抑制乳腺癌肿瘤转移。该研究成果刊登在国际顶级期刊Cancer Cell(IF:23.893)。(芯片實驗由數譜提供技術服務)
研究背景
NF-kB是一个在炎症、免疫、细胞增殖和细胞分化等过程中发挥关键作用的转录因子。NF-kB是联系炎症与肿瘤的关键分子,炎症条件下,NF-kB组成性持续激活,促进肿瘤细胞侵袭和转移。lncRNAs是一类转录本长度超过200nt的RNA分子,无蛋白质编码功能。近来的研究发现,lncRNA在多个层面调控基因表达,并且能够调控肿瘤细胞增殖、凋亡、转移、代谢、衰老和抗药性。但是lncRNA在NF-kB信号通路和肿瘤相关的炎症反应中的作用尚不清楚。宋尔卫教授课题组本次研究目的在于揭示lncRNA与NF-kB信号通路及乳腺癌肿瘤转移间的关系。
研究思路
研究表明,炎症因子能够激活乳腺癌细胞中的NF-kB信号通路。作者利用Arraystar Human LncRNA芯片检测多种炎症因子((TNF)-a, IL-1b 和LPS)处理的乳腺癌细胞(MDA-MB-231)。与PBS处理的对照组比较,炎症因子处理的乳腺癌细胞中分别有23个上调10倍的lncRNAs和28个下调10倍的lncRNAs。其中,NKILA在三组炎症因子处理中均上调12倍以上,并且Northern blot和RT-PCR证实NKILA在炎症因子处理的乳腺癌细胞中显著增加。作者随后利用一系列生物学手段对NKILA的特征进行揭示:5’-和3’-RACE实验获得NKILA全长序列;序列分析显示NKILA不具有编码蛋白质的能力;荧光原位杂交(FISH)结合共聚焦实验显示NKILA主要定位于细胞质,并通过核质分离实验得到验证。
对于NKILA的功能,体外细胞实验显示,在乳腺癌细胞中NKILA能够显著促进细胞凋亡,抑制肿瘤细胞侵袭,这与NF-kB抑制细胞凋亡、促进肿瘤侵袭的功能相反。体内动物实验显示,对于异种移植乳腺癌细胞的小鼠模型,过表达NKILA能够降低NF-kB活性,抑制肿瘤转移,小鼠生存时间长;反之,沉默NKILA能够增加NF-kB活性,促进肿瘤转移,小鼠生存时间短。
为了研究NKILA与NF-kB信号通路的关系,作者分别利用RNA-IP、RNA pull-down、RNA EMSA、蛋白-RNA结构分析、荧光素酶报告基因、ChIP和EMSA等实验进行探索。数据表明NF-kB能够结合NKILA启动子,促进NKILA基因表达。在转移性乳腺癌中高表达的miR-103/-107能够快速降解NKILA,抵消NF-kB对NKILA的促进作用。同时,作者发现NKILA可结合NF-kB/IkB形成稳定的复合物,并直接遮盖IkB的磷酸化motif,由此抑制了IKK诱导的IkB磷酸化以及NF-kB激活,形成负反馈。
作者进一步利用多达上千例的乳腺癌临床标本研究NKILA的临床意义。原位杂交实验显示,NKILA在癌旁组织中高表达,在低转移的乳腺癌组织中表达降低,在高转移的乳腺癌组织中表达水平最低。RT-PCR结合生存曲线表明,高表达的NKILA与乳腺癌患者的不良预后密切相关,可以作为潜在的乳腺癌预后生物标记物。
技術路線
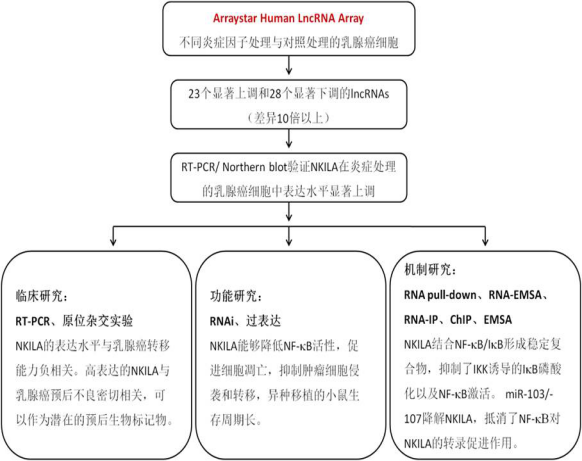
結果展示
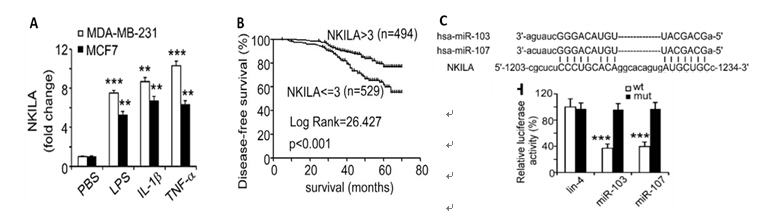
圖A. RT-PCR验证结果显示NKILA在三种炎症因子处理的乳腺癌细胞中表达水平显著升高,与芯片数据相符;
圖B. RT-PCR结合预后K-M曲线,显示NKILA高表达与乳腺癌预后不良密切相关;
圖C. 图示miR-103/-107与NKILA的结合位点,荧光素酶报告基因实验确认miR-103/-107调控NKILA表达水平;
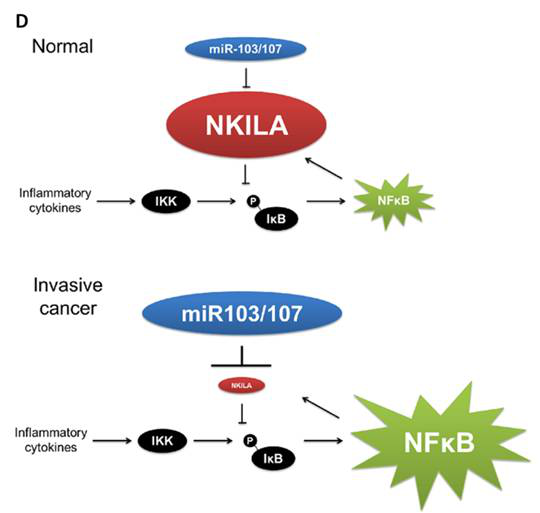
圖D. 模型展示:在转移性乳腺癌中,NF-kB活性高,促进NKILA表达;而在转移性乳腺癌中高表达的miR-103/-107能够快速降解NKILA,抵消NF-kB对NKILA的促进作用。
研究意義
该研究首次揭示了lncRNA与NF-kB信号通路的关系。转录因子NF-kB通过结合NKILA启动子,促进NKILA基因表达。在转移性乳腺癌中高表达的miR-103/-107能够快速降解NKILA,抵消NF-kB对NKILA的促进作用。大量实验表明NKILA可结合NF-kB/IkB形成稳定的复合物,并直接遮盖IkB的磷酸化motif,由此抑制了IKK诱导的IkB磷酸化以及NF-kB激活,形成负反馈。在炎症条件下,NKILA对于阻止NF-kB信号通路在乳腺细胞中的过度激活起到关键作用。同时,大量乳腺癌临床标本的研究表明,高表达的NKILA与乳腺癌患者的不良预后密切相关。这些研究提供了乳腺癌的潜在治疗靶点和预后生物标记物。
原文出處
A Cytoplasmic NF-kB Interacting Long Noncoding RNA Blocks IkB Phosphorylation and Suppresses Breast Cancer Metastasis. Cancer Cell, 2015, 27, 370–381.

