
djcpCu
STECLRsgUenWYuzOrUZgeIxQteHGktFRYgLwtJJiHT
HXvjYapofLAZKFEzUjnCHvFXdCfZ
jnNmjjoj

|
單細胞測序技術服務 靶向lncRNA单细胞全转录组测序 單細胞全轉錄組測序 |
|
生物分子凝聚體研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 RIME MS CoIP-MS |
|
NGS测序技术服务 R-loop 测序分析服务 |
|
NGS测序技术服务 環狀DNA测序 |
|
基因芯片技術服務 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表觀轉錄組學測序服務 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
Ribo-seq Ribo seq |
核糖體-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |
|
蛋白表達定量 Label free非标定量技术 TMT标记定量技术 PRM靶向定量 |
“基因下游”(DoG)RNA是指在大約10%的宿主基因下游产生的RNA轉錄本,与其上游RNA相連 [1]。DoG的定義是在哺乳動物細胞中,转录终止位点(TES)的多聚腺苷酸信号(PAS)后,5 ~200 kb的RNA序列[1]。由于其长度较长,DoG常常與其他下游轉錄單元重疊,被称为读入基因(图1)[2, 3]。
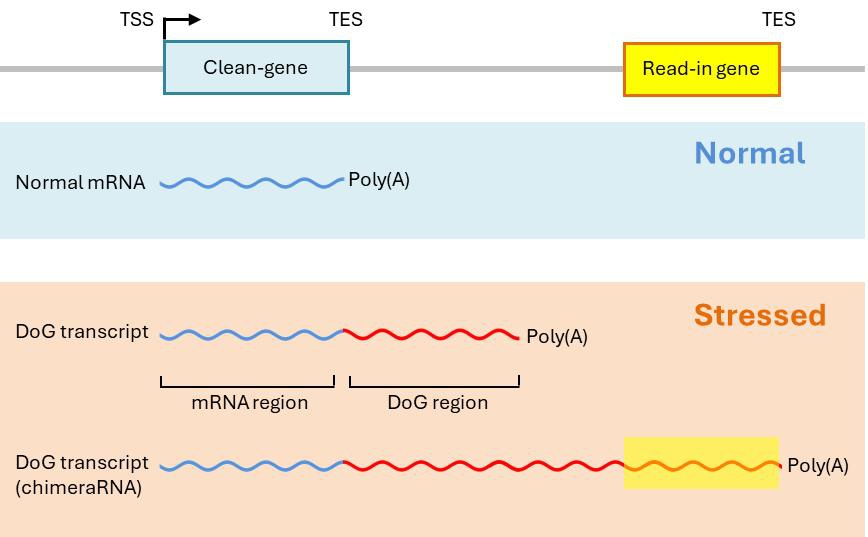
圖1.:在正常條件下,转录产生正常的mRNA,并没有读入转录的现象。细胞压力可以诱导“基因下游”转录本(DoGs)的产生。其中一些可以延伸转录到其下游基因,称为“读入”基因[2, 3]。合成后,许多DoGs保持在其轉錄位點附近,而其他一些则释放到核浆中[1, 4]。已经检测到聚腺苷酸化和非聚腺苷酸化的DoGs水平相似[5]。缩写:TSS,转录起始位点;TES,转录终止位点。
DoGs的分子特徵
DoGs是因爲轉錄通讀產生的,即当新生mRNA的3’端终止不完全时,导致转录延续超出了基因的正常末端。DoGs具有三個明顯特徵(图1)[7]:(1)它們的轉錄始於蛋白編碼基因的啓動子。DoGs的產生不涉及從獨立的轉錄起始位點(TSS)进行新生转录初始化。(2)它们可以超出宿主基因的3’端聚腺苷酸化信号(PAS)后连续延伸至少5千鹼基。(3)它们主要定位在细胞核,并且很可能与染色质相关。值得注意的是,DoG的產生獨立於宿主基因的轉錄活動,它们的调控机制是独立并脱钩的。
DoGs的生物發生
正常的轉錄終止需要多個事件共同協調,包括减速、暂停和RNA聚合酶RNAPII的脫落以及RNA轉錄物的3’端剪切。这些步骤中的任何扰动都可能影响转录终止并导致转录通读(图2)。细胞压力,如渗透压应力[5]、热休克[8]、病毒感染[3, 9] 或致癌突變,都可以导致异常的转录终止。 在壓力條件下,许多基因因为无法识别PAS或轉錄物剪切和聚腺苷化因子功能障礙無法正確終止轉錄,导致转录通读。此外,产生DoGs的基因通常具有獨特的染色質特徵,使它们更易产生转录通读[3],例如富集的组蛋白修饰标记(例如H3K36me3和H3K79me2等)会促进转录延伸[10] 或弱化聚腺苷酸化信號(PAS)。
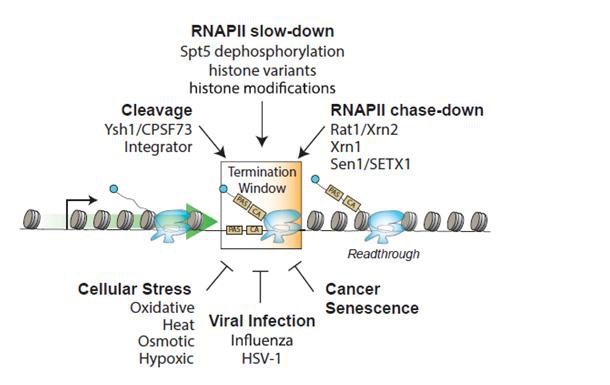
圖2: 通過促進(图上方)或阻碍(图下方)RNAPII轉錄終止的調控因子、机制或细胞条件来调控转录终止。细胞压力、病毒感染、癌症和衰老导致的转录终止缺陷可能导致转录通读和DoG產生。
相關服務
Downstream-of-Gene Transcript (DoG RNA)芯片
相關資源
在疾病中DoGs对基因转录的调节功能探究
DoGs形成了嵌合RNA和环状RNA
參考文獻
1. Vilborg A et al: Widespread Inducible Transcription Downstream of Human Genes. Mol Cell 2015, 59(3):449-461.[PMID: 26190259]
2. Grosso AR et al: Pervasive transcription read-through promotes aberrant expression of oncogenes and RNA chimeras in renal carcinoma. Elife 2015, 4.[PMID: 26575290]
3. Rutkowski AJ et al: Widespread disruption of host transcription termination in HSV-1 infection. Nat Commun 2015, 6:7126.[PMID: 25989971]
4. Hennig T et al: HSV-1-induced disruption of transcription termination resembles a cellular stress response but selectively increases chromatin accessibility downstream of genes. PLoS Pathog 2018, 14(3):e1006954.[PMID: 29579120]
5. Rosa-Mercado NA et al: Hyperosmotic stress alters the RNA polymerase II interactome and induces readthrough transcription despite widespread transcriptional repression. Mol Cell 2021, 81(3):502-513 e504.[PMID: 33400923]
6. Rosa-Mercado NA, Steitz JA: Who let the DoGs out? - biogenesis of stress-induced readthrough transcripts. Trends Biochem Sci 2022, 47(3):206-217.[PMID: 34489151]
7. Morgan M, Shiekhattar R, Shilatifard A, Lauberth SM: It's a DoG-eat-DoG world-altered transcriptional mechanisms drive downstream-of-gene (DoG) transcript production. Mol Cell 2022, 82(11):1981-1991.[PMID: 35487209]
8. Cugusi S et al: Heat shock induces premature transcript termination and reconfigures the human transcriptome. Mol Cell 2022, 82(8):1573-1588 e1510.[PMID: 35114099]
9. Heinz S et al: Transcription Elongation Can Affect Genome 3D Structure. Cell 2018, 174(6):1522-1536 e1522.[PMID: 30146161]
10. Vilborg A et al: Comparative analysis reveals genomic features of stress-induced transcriptional readthrough. Proc Natl Acad Sci U S A 2017, 114(40):E8362-E8371.[PMID: 28928151]

