
vLUFVvYOvCxxYEZVpTFeWBbNXKpeaFPOVCGANCXGUPXKsCmXnye
DVbkaSNCzuuzjxjhXYFwIPlRhTNkIdvIKYrJbdwPNrfyATxnGnX
kqyjcLguyenCFG
JimOxZJxxvUYWrPCCaEDzfjsDRwTmUrYZxiIGBxlFuGpJnbnkCRzukvSPogDDANpztBbOqFueHjlOsZPsqQTKUdjoWAVAULoUtXAWtCZtDUWqxXZrVGSLTFR
QbgkaVLHZ
HStHNmZzGcf
NZaLRfWrvVjolldpLhmIorUrDdYYiItScXKnBYNKbRoptmdHUrPkhwEIxPnIyAdlpBwaQhtartOgPRdfxRZJYBtetoWpQcCyfNldFk
XGVaaQEYvdSPlskhITjHQOJSROjlD
guyzTDnkAHPCdfnPXTmLYRDDc
|
單細胞測序技術服務 靶向lncRNA单细胞全转录组测序 單細胞全轉錄組測序 |
|
生物分子凝聚體研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 RIME MS CoIP-MS |
|
NGS测序技术服务 R-loop 测序分析服务 |
|
NGS测序技术服务 環狀DNA测序 |
|
基因芯片技術服務 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表觀轉錄組學測序服務 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
Ribo-seq Ribo seq |
核糖體-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |
|
蛋白表達定量 Label free非标定量技术 TMT标记定量技术 PRM靶向定量 |
南京医科大学许林教授长期从事肺癌的临床和基础研究,肿瘤早期诊断分子标记物及分子致病机理的相关研究,近期该课题组发表了题为“Super-enhancer hijacking LINC01977 promotes malignancy of early-stage lung adenocarcinoma addicted to the canonical TGF-β/SMAD3 pathway”的研究性论文,该文章采用Arraystar超級增強子lncRNA芯片篩選發現LINC01977被超级增强子诱导大量表达,并通过调控TGF-β/SMAD3通路,促进肺腺癌的预后恶化。实验结果显示,linc01977在肺腺癌病人组织和细胞系中,表达量均明显上调。功能研究结果展示linc01977可增强肺腺癌细胞的增殖和迁移能力,敲低linc01977可显著抑制肺腺癌细胞体外增殖。机制研究发现,linc01977与SMAD3结合介导其在细胞核内的积累,激活SMAD3与CBP/P300的相互作用;同时在TGF-β的刺激下表观调控下游靶基因ZEB1,从而促进肿瘤迁移。该研究成果于2022年发表于学术期刊Journal of Hematology & Oncology,影响因子为23.168(Arraystar超級增強子lncRNA芯片由给我免费播放片高清在线观看生物|數譜生物提供技術服務)。

研究背景
肺癌是世界上最常见的肿瘤类型之一,其中肺腺癌(Lung adenocarcinoma, LUAD)发病率在所有肺癌病例中占比高达40%。切除或联合辅助化疗/放疗的早期LUAD患者有许多会在5年内复发,导致预后恶化。尽管目前已在识别和治疗疾病复发的方法方面取得了长足的进步,但其分子机制仍未得到完整的阐明,因此,发现肺腺癌新的诊断标志物和治疗靶点、揭示导致疾病复发和预后恶化的机制依然极为重要。
超级增强子(super-enhancer, SE)是指具有增强子活性的基因组区域,它通过募集核心调节回路转录因子来介导人类癌症中的转录失调,SE还可产生增强子RNA(eRNA)或劫持启动子促进lncRNA的大量表达,这种lncRNA被称为超增强子相关lncRNA(SE-lncRNA)。据报道,TP63和SOX2通过激活其在鳞状细胞癌中的SE和启动子来协同调节lncRNA LINC01503的表达。受SE和TP63调控的LINC01503激活ERK和AKT通路,促进鳞状细胞癌的进展。然而,在LUAD中SE-lncRNA的功能仍然未知。
研究思路
文章着重于研究SE-lncRNA在肺腺癌中的主要功能和调控机制,作者运用Arraystar超級增強子lncRNA芯片檢測5对LUAD癌和癌旁组织中SE-lncRNA的表达水平,采用差异倍数≥2,且P值<0.05筛选出尚未报道过的LINC01977分子,经过超级增强子marker H3K27Ac和H3K4me1 ChIP-Seq验证,LINC01977在肿瘤组织中的表达被SE显著增强,与预后不良密切相关,具有良好的诊断价值。
功能研究发现,在LUAD 细胞系A549中敲低LINC09177抑制细胞增殖,S期细胞减少,细胞自噬得到增强,迁移能力减弱,降低了细胞的克隆形成;裸鼠移植实验发现,抑制LINC01977使肿瘤与对照组相比体积更小、重量更轻且生长迟缓,表明LINC01977的高表达显著促进LUAD的恶性发展。
机制研究分离核质RNA、FISH等实验发现LINC01977定位于细胞核,RNA pulldown揭示LINC01977依赖MH2结构域与SMAD3蛋白结合,促进其在细胞核内的积累,并在TGF-β刺激下促进SMAD3和CBP/P300之间的相互作用,LINC01977通过参与SMAD3/CBP/P300复合物,促进ZEB1启动子H3K27Ac修饰,激活下游肿瘤转移的核心因子ZEB1转录, ZEB1的高表達促進了腫瘤細胞EMT转移过程。被SE劫持的LINC01977可以作为早期LUAD治疗的潜在靶点。
技術路線

結果展示
1. 高通量篩選
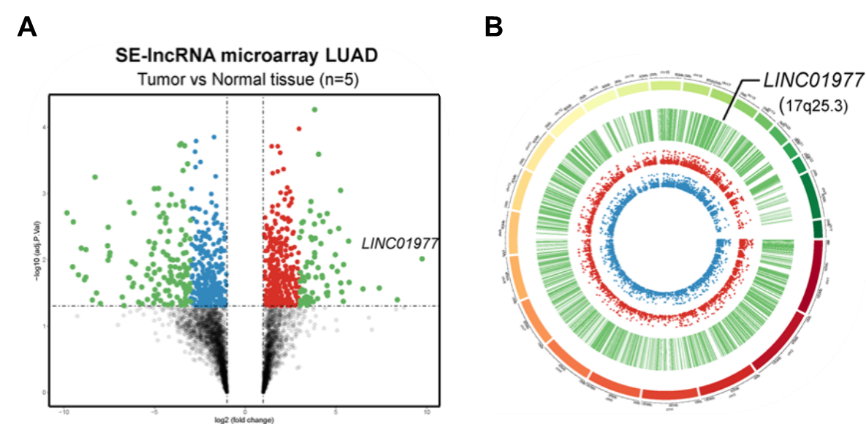
图1:LAUD癌和癌旁组织中的SE-lncRNA表达谱发生明显变化。
A Arraystar SE-lncRNA芯片结果的火山图显示LINC01977在癌组织表达上调;
B差异表达SE-lncRNA的circos图。
2. qPCR驗證與臨牀應用
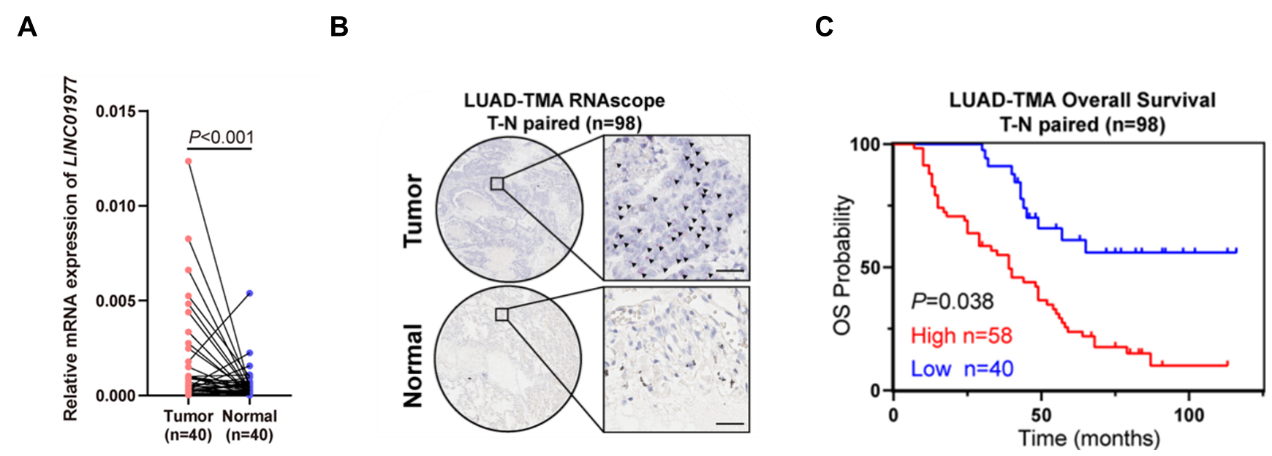
图2:LINC01977在LUAD组织中高表达的验证。
A LUAD癌vs.癌旁组织(n=40)qPCR验证LINC01977表达上调;
B LUAD癌vs.癌旁组织(n=98)RNA scope原位杂交检测LINC01977表达上调;
C KM分析表明LINC01977高表达与预后不良密切相关
3. 功能實驗
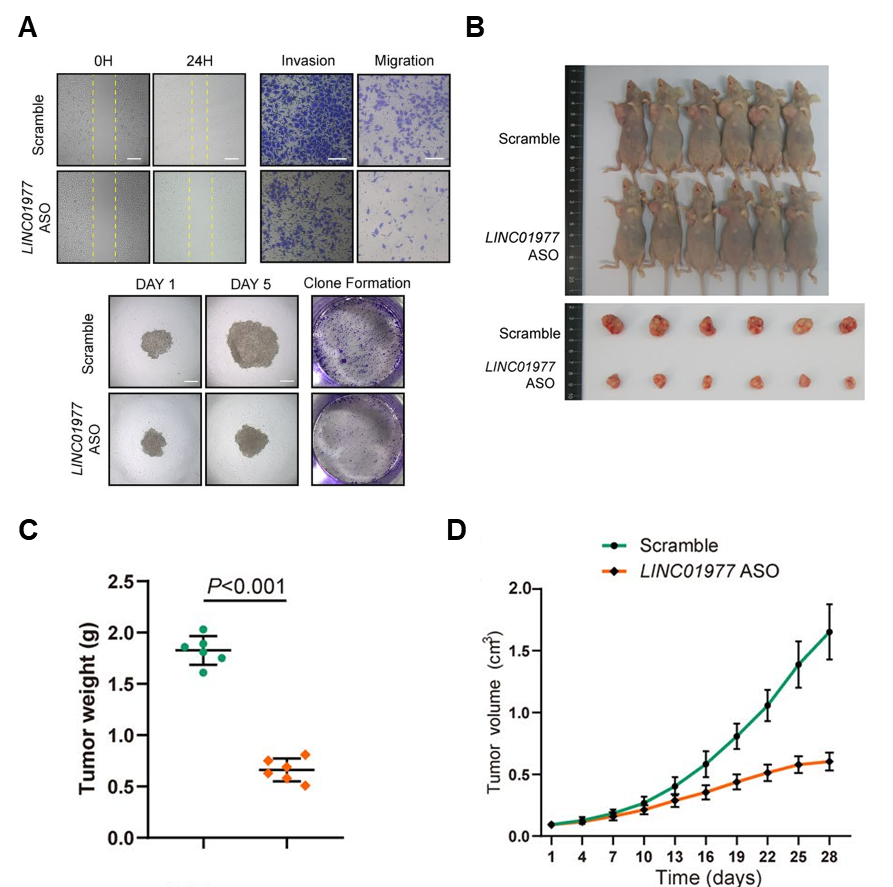
图3:功能研究证实LINC01977的表达促进LUAD肿瘤的恶性发展。
A In vitro实验证明敲低LINC01977减弱A549细胞的迁移(上图)和增殖能力(下图);
B-D In vivo实验证明敲低LINC01977抑制移植肿瘤发展(C, 肿瘤重量;D, 肿瘤体积)。
4. 機制實驗
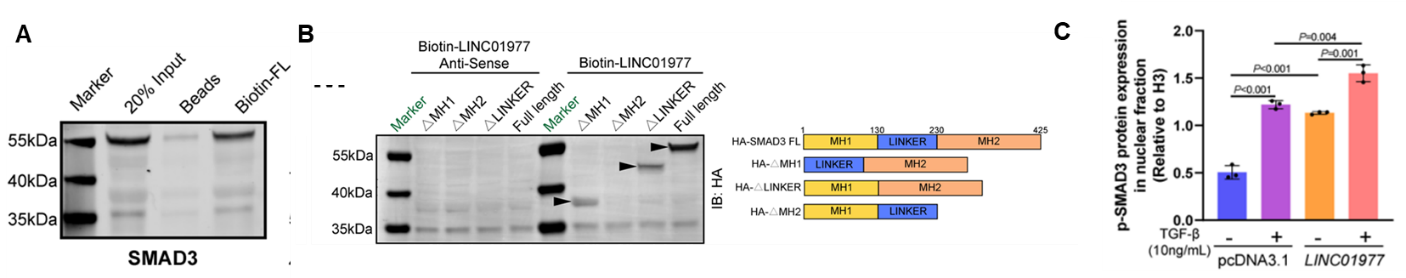
图4:机制研究1,LINC01977通过MH2结构域结合SMAD3。
A RNA pulldown-WB证实LINC01977可结合SMAD3;
B 不同HA标记SMAD3蛋白结构域验证LINC01977与SMAD3 MH2结构域相互作用;
C LINC01977介导SMAD3蛋白在细胞核中的积累。
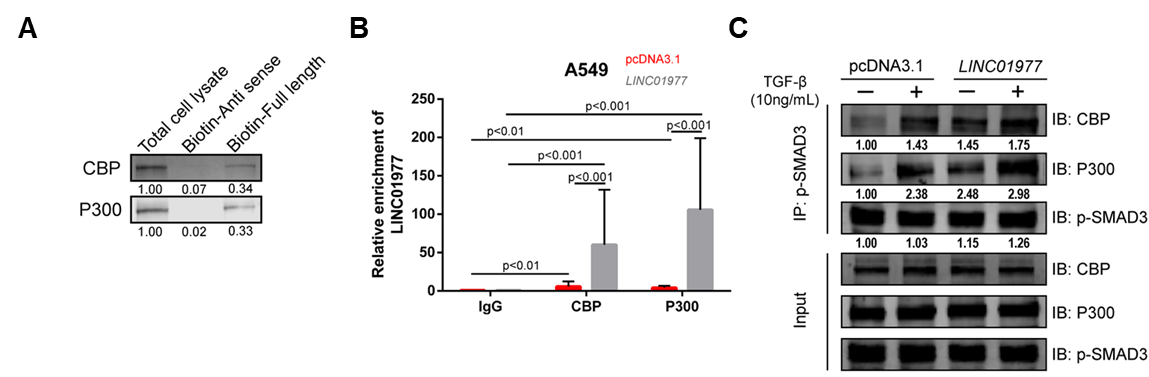
图5:机制研究2,LINC01977参与SAMD3/CBP/P300复合物的形成。
A RNA pull-down验证LINC01977和CBP/P300之间的相互作用;
B RIP和qRT-PCR验证LINC01977和CBP/P300之间的相互作用;
C TGF-β处理下LINC01977/SMAD3与CBP/P300的相互作用(Co-IP)。
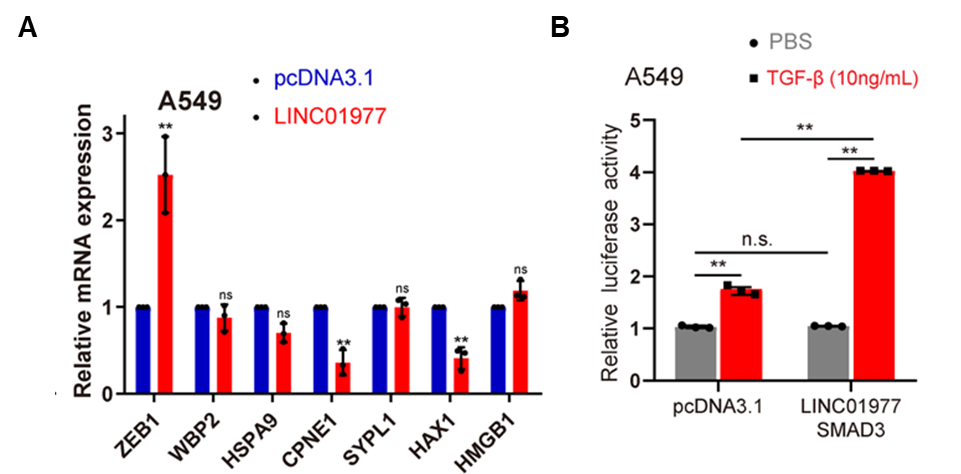
图6:机制研究3,LINC01977在TGF-β刺激下显著提高ZEB1表达水平。
A 过表达LINC01977促进ZEB1表达;
B 转染LINC01977和SMAD3后,ZEB1的转录活性在TGF-β处理的A549 细胞中显著升高。
5. 作用機制圖
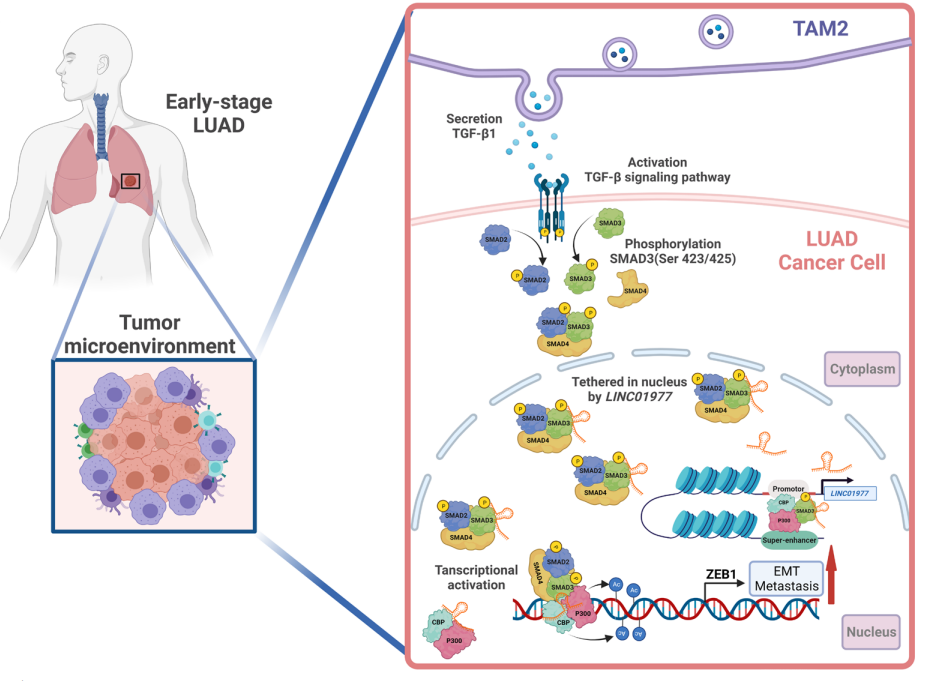
图7:作用机制图
肿瘤微环境中TAM2巨噬细胞激活LUAD肿瘤细胞TGF-β/smad3通路,促进LINC01977上调,LINC01977结合SMAD3并介导其核内积累,参与和促进SMAD3/CBP/P300复合物结合ZEB1并上调其表达,促进肿瘤EMT过程。
研究意義
本研究使用Arraystar SE-lncRNA芯片技術研究LUAD中差异表达的SE-lncRNA,并确定上调的LINC01977被SE劫持,促进体外和体内的肿瘤恶性表型发展,具有良好的病理诊断价值。LINC01977可促进肺腺癌细胞的增殖和迁移,并调控细胞周期和细胞自噬进程。文章讨论了LINC01977结合SMAD3并介导其核内积累,在TGF-β刺激下可参与和促进SMAD3/CBP/P300复合物的建立,并导致下游基因ZEB1的表观遗传激活。由于LINC01977高表达的LUAD患者在早期阶段生存期较短、预后较差,而SE-lncRNA作为早期 LUAD 的重要调控分子和治疗靶标具有良好的诊断和治疗潜力,为LUAD的治疗提供了新的思路。
原文出處
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-022-01331-2
给我免费播放片高清在线观看生物丨数谱生物可提供的相关技术服务
RIP-PCR
CO-IP-MS
