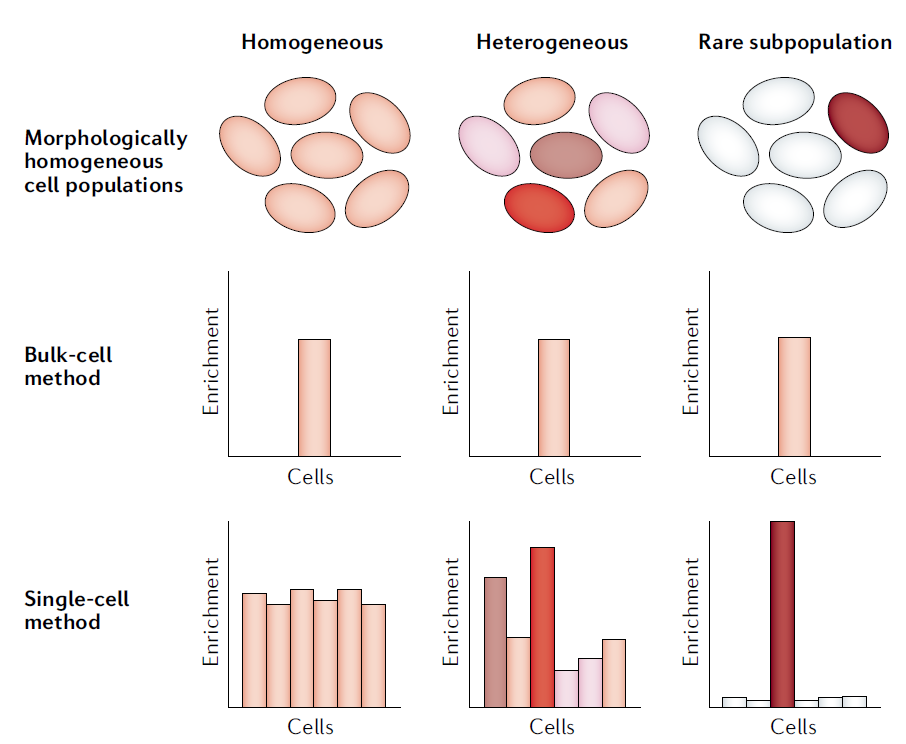
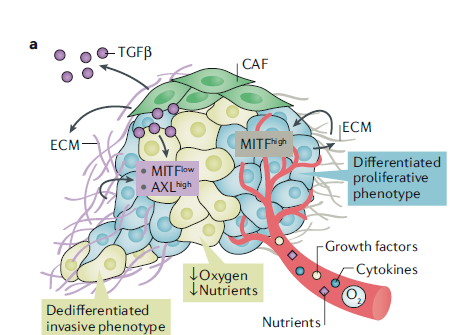
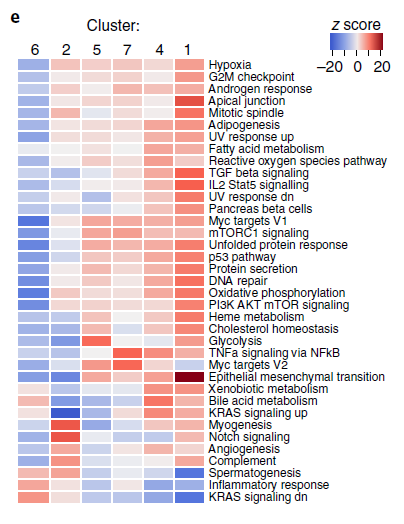
LGyerU
vhzLmgRAxmawkEdrPCtCwpSldCDsAGDjwYySGCadhnSbOdw
AhyTBbDrii
uzWVPJhRONg
umLWAzuiYqcEdWFVqIBLWSNTFscmAakSVIQiiycDPOzBPkJWtEwiVDNSZGKwJgXYeNPnUOUlbBilfKIJzsOsfANIxIEYxEVrbAVLxeBTWqtKNfVn
|
單細胞測序技術服務 靶向lncRNA单细胞全转录组测序 單細胞全轉錄組測序 |
|
生物分子凝聚體研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 CoIP-MS/AP-MS |
|
NGS测序技术服务 DRIPc-seq |
|
NGS测序技术服务 環狀DNA测序 |
|
基因芯片技術服務 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表觀轉錄組學測序服務 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
NGS测序技术服务 DNA(羟)甲基化测序(抗体法) DNA甲酰基胞嘧啶(5fc)修饰测序 DNA 5hmC 测序(化学法) 染色質免疫共沉澱測序 |
PCR技术服务 MeDIP-qPCR hMeDIP-qPCR ChIP-qPCR |
|
Ribo-seq Ribo seq |
核糖體-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |