
spuggDYhhrzsQaOgd
gTlNXDVUooNfXTpvYpyEzbbddkwfuZKYLxvpRpCAiZsysTthvkcfruVgjcinHjnxiDzBRsaTEgpgNfmiyEQWtqBmCSvKQDw
hlVgnCKzvbXd
ysKqPgqklFmaXJUnNoETGliKgSZY
rbaxpBEtkOmOIWDcwynKiICCImGNQmpNnHaotapuK

|
單細胞測序技術服務 靶向lncRNA单细胞全转录组测序 單細胞全轉錄組測序 |
|
生物分子凝聚體研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 RIME MS CoIP-MS |
|
NGS测序技术服务 R-loop 测序分析服务 |
|
NGS测序技术服务 環狀DNA测序 |
|
基因芯片技術服務 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表觀轉錄組學測序服務 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
Ribo-seq Ribo seq |
核糖體-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |
|
蛋白表達定量 Label free非标定量技术 TMT标记定量技术 PRM靶向定量 |
近日,南方科技大学第一附属医院聂晓伟研究员团队与南方科技大学医学院药理学系卞劲松教授团队在国际心血管领域专业期刊Circulation Research杂志发表了题为“o8G site-specifically modified tRF-1-AspGTC: a novel therapeutic target and biomarker for pulmonary hypertension”的研究文章(IF=20.100)。
该文章利用Arraystar Human Small RNA Modification Microarray在低氧性肺動脈高壓(PH)患者肺组织中对带有o8G修饰的smallRNA进行筛选,找到了o8G修饰水平显著上调的tRF-1-AspGTC,o8G修饰发生在该tsRNA种子区第五位的G上。功能研究表明,抑制5o8G tRF-1-AspGTC降低了低氧诱导的肺动脉平滑肌细胞(PASMCs)增殖能力、逆转了细胞凋亡抵抗。靶基因预测发现,5o8G修饰允许5o8G tRF-1-AspGTC靶向WNT5A和CASP3的mRNA、抑制它们的表达,荧光素酶实验、AGO2 RIP实验和RNA pull down实验也验证了两者的结合关系;WNT5A及CASP3的表达下调通过BMPR2-ROS/5o8G tRF-1-AspGTC/WNT5信号通路直接导致了PASMCs增殖及凋亡抵抗,最终加速了肺动脉高压的进展。该研究凸显了位置特异性的tRF o8G修饰在促进肺动脉高压发展中的作用,提供了一个具有前景的肺动脉高压治疗途径,并提示5o8G tRF-1-AspGTC作为一个潜在的创新性生物分子标志物来诊断该疾病。(其中smallRNA修饰芯片由给我免费播放片高清在线观看生物丨数谱生物提供)

研究背景
非近年来,tRNA和tRNA前体衍生的片段tsRNAs引起了人们越来越多的兴趣,因为它们具有重要的生物学功能。研究发现tsRNAs通过靶向结合mRNA并下调其表达、参与多种疾病进程的调控。tsRNAs在RNA干扰、细胞增殖和对DNA损伤的分子反应中发挥着重要作用。肺动脉高压(PH)是一种复杂且多因素的疾病,尚不能完全阐明其病理机制。因此,探索新的病理机制,理解PASMCs的增殖和凋亡对治疗PH至关重要。研究tsRNAs的功能和参与可能有助于更好地理解PH的发病机制。
作为一种呼吸系统疾病,缺氧环境和氧化还原信号、比如氧化修饰8-氧鸟嘌呤(o8G)对PH的病理过程有着重要调控作用。最近的研究表明,在各种疾病过程中,单链RNA比DNA更容易受到o8G修饰的影响。ROS能氧化miRNAs中的鸟嘌呤产生o8G,由于o8G只能与腺嘌呤(A)配对而非胞嘧啶(C),因此改变了miRNAs种子区域(位置2-8,功能区域)mRNAs的靶向结合关系,这种靶标重定向能够引发信号传导途径的变化。先前的研究表明,在发生o8G修饰后,miR-184能够结合到新的mRNA靶点BCL-XL和BCL-W,并抑制它们的翻译,导致心肌细胞死亡增加。Seok等人报道,miR-1种子区域的o8G修饰能够诱导小鼠心肌肥厚。因此,RNA的o8G氧化修饰可能通过影响氧化还原介导的基因表达和相关疾病的发展,在表观遗传转录调控中起重要作用。然而,tsRNAs是否经过o8G修饰以及o8G修饰的tsRNAs是否涉及PH的发病机制仍未知。
本研究利用Arraystar Human Small RNA Modification Microarray發現5o8G修饰的tRF-1-AspGTC在缺氧条件下表达水平上调,影响PASMC(肺动脉平滑肌细胞)在缺氧条件下的增殖和凋亡抵抗中的作用,该分子可以作为PH治疗靶点和潜在的生物标志物。
實驗思路

實驗方法
SmallRNA修饰芯片筛选发现O8G修饰差异tsRNA与肺动脉高压相关
在文章的前期研究中,作者发现低氧性肺动脉高压(PH)病人和肺动脉平滑肌细胞(PASMCs)中smallRNA的o8G修饰水平相较正常对照有显著升高。利用Arraystar Human Small RNA Modification Microarray,作者在低氧性肺动脉高压(PH)患者肺组织中对带有o8G修饰的smallRNA进行筛选,发现有36个miRNA和51个tsRNA具有显著o8G修饰差异(差异倍数>2,P<0.05)。qPCR验证发现,种子区5位碱基上发生o8G的tRF-1-AspGTC在低氧PH病人和PASMCs细胞中均上调显著,可作为后续研究目标。
tsRNA功能实验证实5o8G tRF-1-AspGTC影响肺动脉增殖、凋亡和增厚
为进一步了解5o8G tRF-1-AspGTC对肺动脉高压的发病的影响,作者利用5o8G tRF-1-AspGTC mimics和inhibitor进行了in vitro过表达和敲低的功能实验,EdU等实验证明,抑制5o8G tRF-1-AspGTC降低了缺氧引起的PASMCs增殖。流式细胞术和TUNEL等实验证明,抑制5o8G tRF-1-AspGTC减弱了缺氧引起的PASMCs凋亡抵抗。In vivo PH小鼠模型免疫荧光和WB实验证明,抑制5o8G tRF-1-AspGTC逆转了SuHx引起的肺动脉增厚,Hematoxylin染色等结果显示通过抑制5o8G tRF-1-AspGTC,大部分缺氧诱导的肺血管增厚得到了显著改善。
机制实验证明5o8G tRF-1-AspGTC结合并下调靶基因CASP3和WNT5A
为了研究5o8G tRF-1-AspGTC调控基因表达的潜在分子机制,文章利用miRanda分析发现,发生5o8G修饰后,tRF-1-AspGTC的种子区域可以结合新靶点——WNT5A和CASP3 mRNA的3’UTR。AGO2 RIP PCR结果显示,5o8G tRF-1-AspGTC、WNT5A mRNA和CASP3 mRNA都可在RNA诱导沉默复合物的关键蛋白AGO2富集产物中被检测到。RNA pulldown实验显示,biotin标记的5o8G tRF-1-AspGTC可以富集WNT5A和CASP3 mRNA。双荧光素报告基因实验也证明了5o8G tRF-1-AspGTC与WNT5A和CASP3 mRNA 3’UTR的直接结合。
BMPR2是由低氧诱导的PH关键突变基因。流式细胞术等实验表明, BMPR2沉默后PASMCs中的ROS水平显著增加,进而上调了5o8G tRF-1-AspGTC的表达,这些结果共同证明BMPR2-ROS/5o8G tRF-1-AspGTC/WNT5A信号轴在PH进展中发挥重要作用。
結果展示
1. SmallRNA修饰芯片筛选发现O8G修饰差异tsRNA与肺动脉高压相关
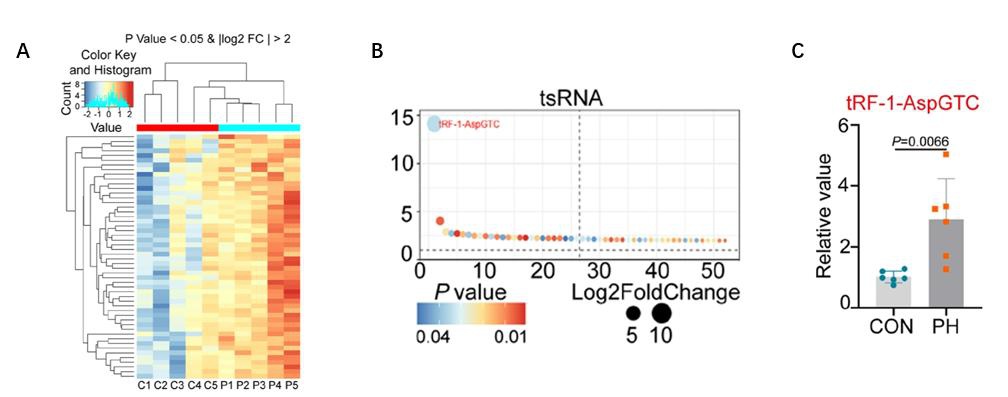
图1:A.聚类图显示缺氧PH病人中o8G修饰的tsRNA上调;B. 根据差异倍数降序排列,tRF-1-AspGTC修饰上调倍数最高;C. qPCR验证显示tRF-1-AspGTC在缺氧PH病人中上调
2. 功能實驗證實o8G tsRNA影响肺动脉增殖、凋亡和增厚
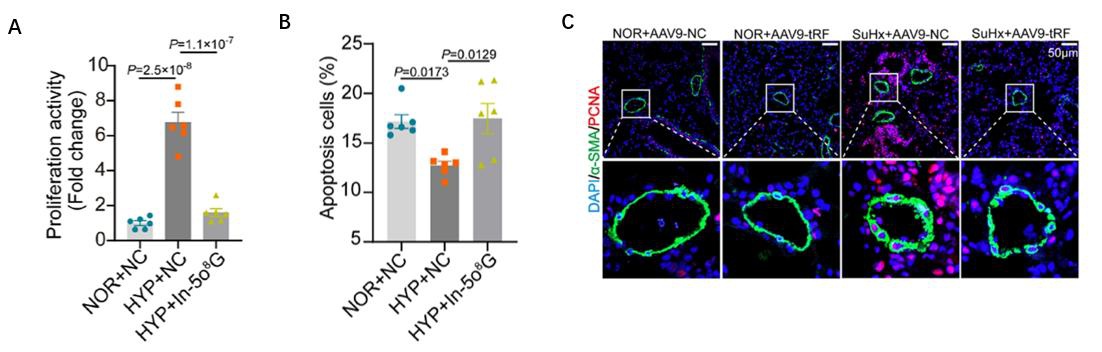
图2:A. EdU实验发现,抑制5o8G tRF-1-AspGTC降低了缺氧引起的PASMCs增殖;B. 流式细胞术显示,抑制5o8G tRF-1-AspGTC减弱了PASMCs对缺氧引起的凋亡抵抗;C. 免疫荧光染色显示SuHx小鼠模型肺血管管壁增厚。
3. 機制實驗證明5o8G tRF-1-AspGTC结合并下调靶基因CASP3和WNT5A
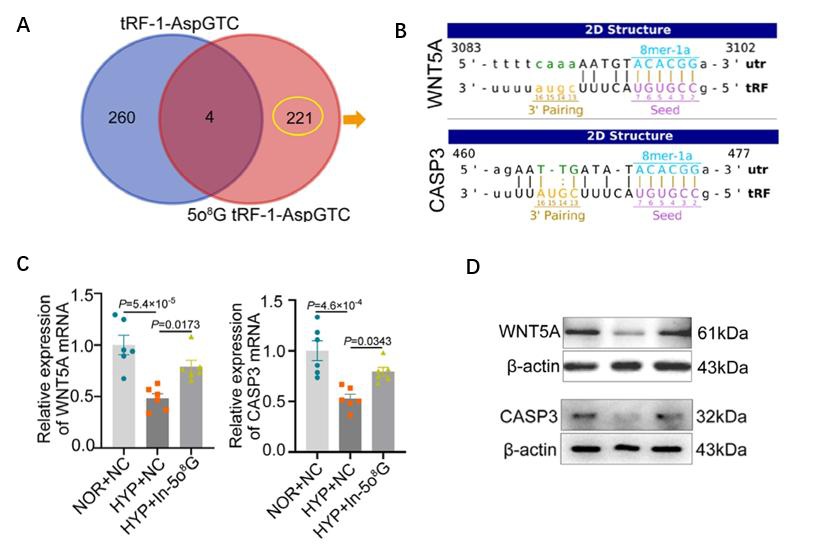
图3:A. 韦恩图显示O8G修饰使得5o8G tRF-1-AspGTC可以靶向221个新靶基因;B. miRanda软件预测了5o8G tRF-1-AspGTC的种子区域与WNT5A和CASP3 mRNA的3’UTR区域之间的结合位点;C. qPCR分析显示,在缺氧条件下抑制5o8G tRF-1-AspGTC减弱了PASMCs中CASP3和WNT5A mRNA的表达。D. WB实验表明,在缺氧条件下抑制5o8G tRF-1-AspGTC减弱了PASMCs中CASP3和WNT5A蛋白的表达。
4. 機制實驗證明5o8G tRF-1-AspGTC结合并下调靶基因CASP3和WNT5A
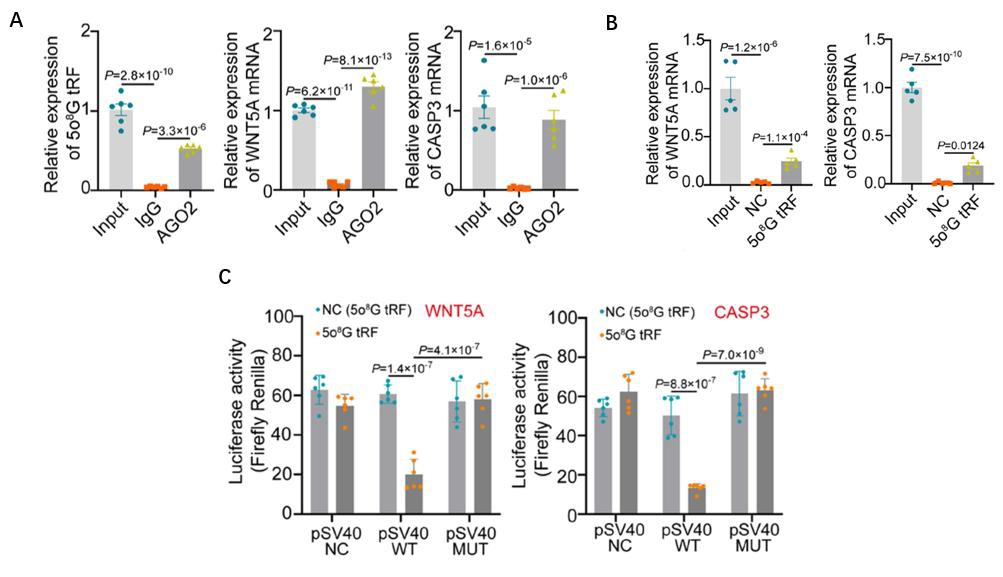
图4:A. AGO2 RIP-PCR实验显示,在anti-AGO2 IP产物中检测到了PASMCs中的5o8G tRF-1-AspGTC、WNT5A mRNA和CASP3 mRNA的表达;B. 5o8G tRF-1-AspGTC RNA pull down实验显示富集到了WNT5A mRNA和CASP3的mRNA;C.使用双荧光素酶分析验证了5o8G tRF-1-AspGTC与WNT5A和CASP3 mRNA在293T细胞中的相互作用。
研究意義
本研究通过Arraystar Human Small RNA Modification Microarray篩選了低氧性肺動脈高壓(PH)患者肺组织中带有o8G修饰的smallRNA,发现了5o8G tRF-1-AspGTC在缺氧PH患者和PASMCs细胞中显著上调。发生5o8G修饰后,5o8G tRF-1-AspGTC的种子区域可以结合新靶点WNT5A和CASP3 mRNA,影响缺氧肺动脉高压的PASMCs细胞的增殖、凋亡和肺动脉的增厚,进而影响疾病进展。这项研究首次证明了5o8G tRF-1-AspGTC是治疗PH的重要靶点,而5o8G tRF-1-AspGTC的抑制剂可能有望作为新药物用于治疗PH。此外,5o8G tRF-1-AspGTC的水平与肺动脉收缩压和平均肺动脉压呈正相关,表明其具有作为低氧性PH的预测、诊断标志物潜力。
原文出處
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.124.324421
给我免费播放片高清在线观看生物丨数谱生物可提供的相关技术服务
Arraystar Human Small RNA Modification Microarray
RNA pull down实验

