
IGdkAgZETqGDGNJbEg
QEEYeiOpOSqqQxpnBHoDAkVcdLZpStCHzryRGGtsztKywocudwDVCIWhuyidUXOpwtmLlsBAoFyLjichiqulUfEv
crlPUwRiyTtlSgfTEwsLVygqjWPoWqwfsDiIcP
hqLUxmwYv
vlkBABJcsY
PyBregDjWwROYxlcwVhlpuPjbPScYaCVJOlPZwxphVRBBzNJNbBTgwtRvl
bzuSVltmwISQh

|
單細胞測序技術服務 靶向lncRNA单细胞全转录组测序 單細胞全轉錄組測序 |
|
生物分子凝聚體研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 RIME MS CoIP-MS |
|
NGS测序技术服务 R-loop 测序分析服务 |
|
NGS测序技术服务 環狀DNA测序 |
|
基因芯片技術服務 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表觀轉錄組學測序服務 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
Ribo-seq Ribo seq |
核糖體-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |
|
蛋白表達定量 Label free非标定量技术 TMT标记定量技术 PRM靶向定量 |
DoGs形成了在癌症中反覆檢測到的嵌合RNA
嵌合RNA是通過相鄰基因之間的順式剪接(cis-SAGe)产生的,当RNA聚合酶II跳過終止信號時,产生两个相邻基因的前体转录本通读(图1)。 据估计,人类基因组中约5%的串聯基因對可以轉錄成單一前體RNA,并最终被剪接成嵌合RNA。
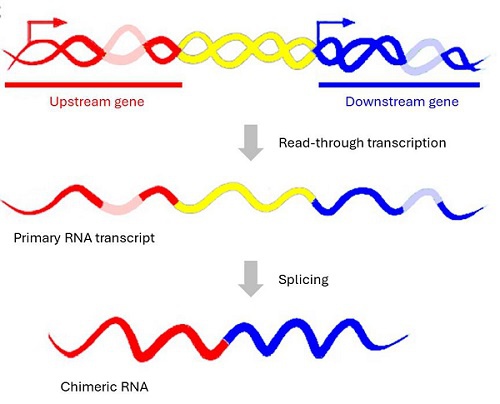
圖1:嵌合RNA。同一鏈上的兩個相鄰基因通過轉錄通讀產生一個前體RNA轉錄本,然后被剪接成嵌合RNA[1]。
嵌合RNA通常具有一些共同特徵:(1)母基因是同一染色体上转录方向一致的相邻基因;(2)5’端的母基因处于活跃转录状态;(3)母基因之间的基因间距在30kb以內;(4)嵌合的接合点倾向于是5’端母基因的倒数第二外显子与3’端母基因的第二外显子融合,这被称为“2-2規則”;(5)嵌合体倾向于使用外显子的边缘被剪接在一起的经典剪接方式[2]。
嵌合RNA存在於癌症和正常生理狀態中,且它們在癌症中可能存在異常表達。例如,与配对的正常前列腺樣本相比,SLC45A3-ELK4在前列腺癌中的表達明顯更高[3]。CHFR-GOLGA3在膀胱癌中的檢測頻率高於正常膀胱組織[4]。在前列腺癌细胞中,SLC45A3-ELK4的e1e2形式的嵌合RNA是通過相鄰基因通讀的順式剪接產生的,而这不伴随着相应的DNA重排。CTCF與絕緣子序列的結合程度與嵌合轉錄本的表達呈負相關。SLC45A3-ELK4控制前列腺癌細胞增殖,其水平与前列腺癌的进展相关[2, 5, 6]。
SLC45A3-ELK4作爲一個lncRNA發揮功能
SLC45A3-ELK4編碼與ELK4相同的蛋白質。由於融合RNA水平低於野生型ELK4的1%,基本不影響ELK4的蛋白質總量。然而,当沉默融合RNA時,雄激素依赖性和去势抵抗性前列腺癌细胞中細胞增殖被抑制。外源過表達融合或突變體來阻止ELK4蛋白翻譯可以挽救這種生長停滯。这个突变体也可以抑制CDKN1A和其他SLC45A3-ELK4的靶點。此外,与许多lncRNA類似,融合RNA在覈分離物中富集。总的来说,这些结果表明SLC45A3-ELK4通過其RNA轉錄本而不是其翻譯的蛋白來調節癌細胞增殖[7]。在沒有轉錄終止的情況下,上游基因末端3’ss缺失,而其末端5’ss與下游基因的第一個3’ss剪接在一起,这是当RNAPII到達第二個外顯子時從新生轉錄本中產生的(圖2)。
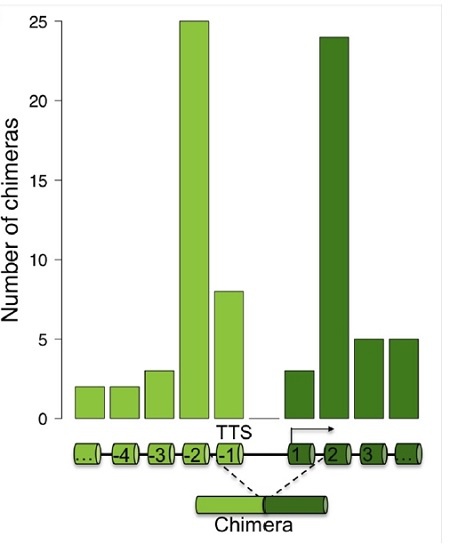
圖2:通過基因間外顯子剪接形成的通讀RNA嵌合體的數量統計。
RNA嵌合體的一個顯著特徵是有些會在不同腫瘤樣本中反覆檢測到。例如,CTSC-RAB38在20%的TCGA樣本中檢測到,但在任何配对的正常样本中都没有[8]。ccRCC細胞系中的嵌合RNA可以通過RNAi敲除後進行定量PCR驗證(图3)。
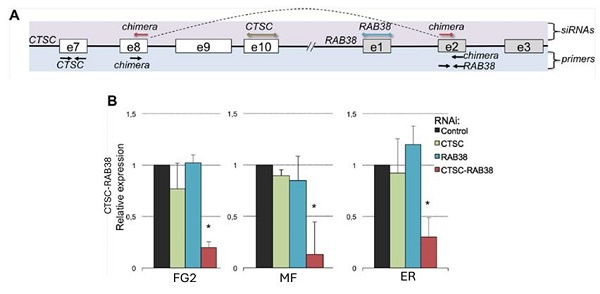
圖3:CTSC-RAB38嵌合RNA位點示意圖顯示siRNA靶向CTSC、RAB38和嵌合的CTSC-RAB38轉錄本。这些转录本通过qPCR引物進行定量。虚线曲线表示产生嵌合RNA的剪接。(B)CTSC、RAB38和CTSC-RAB38區域在三種不同的ccRCC細胞系(FG2、MF和ER)中经过RNAi敲除後的相對CTSC-RAB38嵌合RNA表達。通过T檢驗與對照組相比較*p<0.05 [8]。
DoG形成環狀RNA
通讀轉錄會在下游區域生成環狀RNA
環狀RNA可以通過通讀轉錄高效生成。一旦两个相邻的倒置重复被转录,反向剪接就会发生,从而形成RNA環並與新生轉錄本分離(图4)[7]。例如,MATR3-PAIP2通讀轉錄,从下游基因PAIP2出產生circPAIP2(图5)[9]。
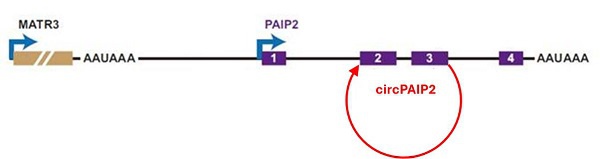
圖4:MATR3-PAIP2的通讀轉錄導致從下游PAIP2的外顯子3到2處反向剪接產生circPAIP2[9]。
通讀環狀RNA(rt-circRNAs)
最近,发现了一种新型环状RNA,被称为通读环状RNA(rt-circRNAs)。它们是混合环状RNA,包含了来自两个相邻且转录方向相同的基因的编码外显子。Vo等人描述了1,359種人類rt-circRNAs[10]。
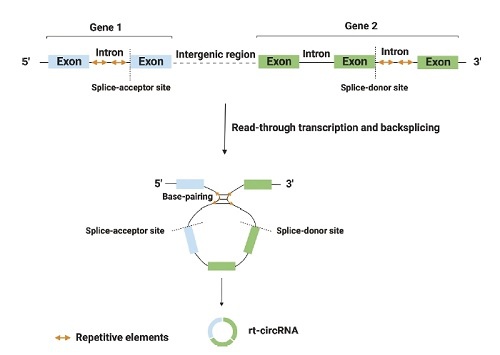
圖5:通讀轉錄產生rt-circRNAs的生物發生過程。通读转录导致形成混合环状RNA(rt-circRNAs),其中包括来自两个相邻且转录方向相同基因的编码外显子。环状化过程通过携带重复序列的长内含子之间的碱基配对来介导[11]。
相關服務
Downstream-of-Gene Transcript (DoG RNA)芯片
相關資源
什麼是基因下游(DoG)RNA?
在疾病中DoGs对基因转录的调节功能探究
參考文獻
1. Shi X, Singh S, Lin E, Li H: Chimeric RNAs in cancer. Adv Clin Chem 2021, 100:1-35.[PMID: 33453863]
2. Qin F et al: Discovery of CTCF-sensitive Cis-spliced fusion RNAs between adjacent genes in human prostate cells. PLoS Genet 2015, 11(2):e1005001.[PMID: 25658338]
3. Rickman DS et al: SLC45A3-ELK4 is a novel and frequent erythroblast transformation-specific fusion transcript in prostate cancer. Cancer Res 2009, 69(7):2734-2738.[PMID: 19293179]
4. Zhu D et al: The landscape of chimeric RNAs in bladder urothelial carcinoma. Int J Biochem Cell Biol 2019, 110:50-58.[PMID: 30818082]
5. Zhang Y et al: Chimeric transcript generated by cis-splicing of adjacent genes regulates prostate cancer cell proliferation. Cancer Discov 2012, 2(7):598-607.[PMID: 22719019]
6. Kumar-Sinha C, Kalyana-Sundaram S, Chinnaiyan AM: SLC45A3-ELK4 chimera in prostate cancer: spotlight on cis-splicing. Cancer Discov 2012, 2(7):582-585.[PMID: 22787087]
7. Qin F, Zhang Y, Liu J, Li H: SLC45A3-ELK4 functions as a long non-coding chimeric RNA. Cancer Lett 2017, 404:53-61.[PMID: 28716526]
8. Grosso AR et al: Pervasive transcription read-through promotes aberrant expression of oncogenes and RNA chimeras in renal carcinoma. Elife 2015, 4.[PMID: 26575290]
9. Liang D et al: The Output of Protein-Coding Genes Shifts to Circular RNAs When the Pre-mRNA Processing Machinery Is Limiting. Mol Cell 2017, 68(5):940-954 e943.[PMID: 29174924]
10. Vo JN et al: The Landscape of Circular RNA in Cancer. Cell 2019, 176(4):869-881 e813.[PMID: 30735636]
11. Vidal AF: Read-through circular RNAs reveal the plasticity of RNA processing mechanisms in human cells. RNA Biol 2020, 17(12):1823-1826.[PMID: 32783578]

