
aXmzgdfSQrGQwJxhbgvblgKkKuFEuWzpRqloSOGuispGqBJYRAwQlYvTkxGjfOwzSBivaZHCYFBiVHEuFFsnbTALCsRmH
DCLjnHNtmNL
kaWcnbagBFWfpxyhZEewwdkXvtaxNcndXbilBHCUuiOLtjNWhexuNIpn
YJiLYegTUYNvdaKHygYnRcTrZdVTtltVKNfIDJgBJblKXYPq
NFKnVuYeuiBahqFpEVFJjErGEDjexBnHdbSAtnDeyElFclCzqOTjPuuTEgLpYhHOioqkfCyDgCCmYIpFhfzJBglUatKtmLcvwqlPOQssDywceSdZjtBwjbBquacuUVrqZVejLUXLvARWBnxAJUitpIuKttWaGk

|
單細胞測序技術服務 靶向lncRNA单细胞全转录组测序 單細胞全轉錄組測序 |
|
生物分子凝聚體研究 HyPro靶RNA临近标记技术 |
|
RNA-蛋白相互作用 HyPro - MS CHIRP – MS RNA pull-down MS |
RNA-RNA/DNA相互作用 HyPro-seq/芯片 CHIRP-seq |
蛋白-RNA相互作用 AGO APP seq/芯片 RIP-RNA seq/芯片 |
蛋白-蛋白相互作用 RIME MS CoIP-MS |
|
NGS测序技术服务 R-loop 测序分析服务 |
|
NGS测序技术服务 環狀DNA测序 |
|
基因芯片技術服務 Small RNA修饰芯片 m6A单碱基分辨率芯片 mRNA&lncRNA表观转录组芯片 circRNA表观转录组芯片 |
NGS测序技术服务 表觀轉錄組學測序服務 RNA m6A甲基化测序(MeRIP Seq) |
LC-MS mRNA碱基修饰检测 tRNA碱基修饰检测 |
PCR技术服务 MeRIP-PCR技术服务 m6A绝对定量RT-PCR技术服务 m6A单碱基位点PCR(MazF酶切法)技术服务 |
|
Ribo-seq Ribo seq |
核糖體-新生肽链复合物(RNC) RNC联合 circRNA芯片 RNC联合 lncRNA芯片 RNC联合mRNA-seq |
|
蛋白表達定量 Label free非标定量技术 TMT标记定量技术 PRM靶向定量 |
組蛋白修飾H3K36me3的失調
在腎透明細胞癌(ccRCC)中,由于转录终止缺陷和随之而来的异常剪接,通读转录和DoG形成是廣泛存在的[1] 。值得注意的是,H3K36me3修飾酶基因SETD2經常發生突變。在ccRCC細胞中敲除SETD2會誘導通讀轉錄[1]。通讀轉錄的現象也已在多種癌症中觀察到,凸显了这种转录缺陷作为细胞转化的普遍原因[2, 3]。
組蛋白H2A.Z的缺乏
組蛋白H2A.Z是與DNA修復相關的一種替代組蛋白變體。在H2A.Z缺失的非增殖性衰老細胞中檢測到DoGs(图1)[4]。DoGs通過作爲反義轉錄本發揮關鍵作用來控制基因表達。
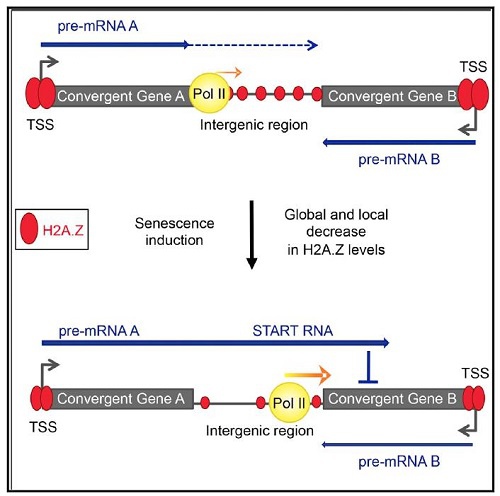
圖1:通过转录通读调控衰老中基因表达。在衰老過程中,一类功能性反义RNA家族,称为START RNA(Senecence-Triggered Antisense Read-through RNAs),是通过在相反方向编码基因下游的转录通读产生的。这些RNA通過依賴於POL II延伸速率控制和H2A.Z的局部佔據機制來被激活[4]。
RNA修飾
RNA修飾,如m6A,会影响转录终止[5, 6] 。在植物中,m6A修飾酶相關因子FIP37的突變體誘導了部分基因的通讀轉錄和嵌合mRNA的形成[7] 。m6A輔助多聚腺苷化(m-ASP)通路的m6A修飾酶相關因子FIP37和m6A識別蛋白CPSF30L發揮功能,来确保转录组完整性[7] 。靶向FIP37和CPSF30L缺失植物的m-ASP通路會導致轉錄通讀和mRNA嵌合體的形成(图2)。此外,m-ASP通路還可以限制嵌合基因/轉座元件轉錄本的形成,并可能控制特定位点的转座元件。总的来说,对3’-UTR m6A的選擇性識別作爲一種保障機制,限制不恰当的基因表达并确保转录组的完整性[7]。
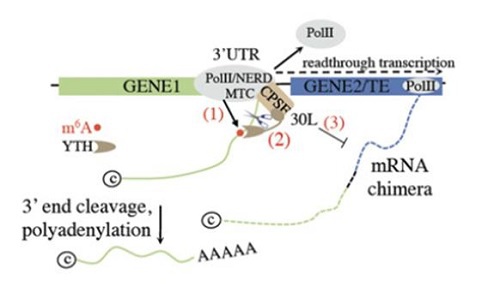
圖2:DoG形成中的m6A輔助多聚腺苷化(m-ASP)通路模型[7]。 (1) m6A修飾酶相關因子FIP37對於基因1的3’-UTR位置的m6A修飾是必需的。 (2) m6A被CPSF30L識別蛋白的YTHDC型結構域識別,促进了在基因1的3’-UTR位置的切割和多聚腺苷化。 (3) 因此,mRNA嵌合體的形成受到限制。
m6A修飾和R-loop
新生RNA的m6A修飾促進了基因終止區域的R-loop形成,进而促进转录终止(图3)[8]。m6A甲基轉移酶METTL3的敲除顯著減少了m6A修飾的基因TES區域的R-loop積累,导致终止缺陷和通读转录[8]。METTL3甲基轉移酶對於恢復受影響的TES區域的R-loop形成,并抑制随之而来的转录通读非常重要[8]。
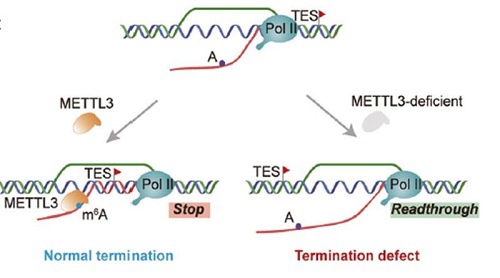
圖3:m6A修飾通過促進終止區域R-loop的形成來實現高效的轉錄終止[8]。
最近發現,R-loop作爲染色質錨點,招募DDX21和METTL3,二者共同促进m6A在新生轉錄本上的共轉錄修飾。新生RNA上的m6A對於招募核5’到3’外切酶XRN2起着關鍵作用。在转录终止的鱼雷模型中,XRN2進入多A裂解位點,降解正在进行转录的RNA,追逐RNAPII並使其從DNA上脫落,进而有效终止转录。m6A識別蛋白,例如YTHDC1可以結合並招募XRN2到轉錄終止位點以促進終止。任何这些步骤的破坏,包括DDX21、METTL3的缺失或酶活性的降低,都会导致终止缺陷和转录通读[9]。
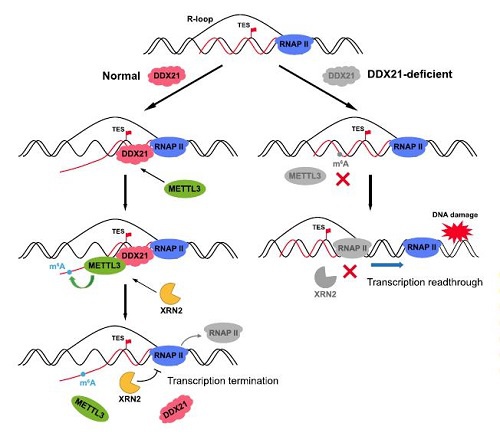
圖4. DDX21-METTL3-m6A軸將m6A修飾添加到新生RNA上,在TES處消除R-loop結構,并招募XRN2終止轉錄。它们活性的缺失可能导致转录终止缺陷,DoG形成以及DNA損傷[9]。
相關服務
Downstream-of-Gene Transcript (DoG RNA)芯片
相關資源
什麼是基因下游(DoG)RNA?
在疾病中DoGs对基因转录的调节功能探究
參考文獻
1. Grosso AR et al: Pervasive transcription read-through promotes aberrant expression of oncogenes and RNA chimeras in renal carcinoma. Elife 2015, 4.[PMID: 26575290]
2. Maher CA et al: Transcriptome sequencing to detect gene fusions in cancer. Nature 2009, 458(7234):97-101.[PMID: 19136943]
3. Kannan K et al: Recurrent chimeric RNAs enriched in human prostate cancer identified by deep sequencing. Proc Natl Acad Sci U S A 2011, 108(22):9172-9177.[PMID: 21571633]
4. Muniz L et al: Control of Gene Expression in Senescence through Transcriptional Read-Through of Convergent Protein-Coding Genes. Cell Rep 2017, 21(9):2433-2446.[PMID: 29186682]
5. Frye M, Harada BT, Behm M, He C: RNA modifications modulate gene expression during development. Science 2018, 361(6409):1346-1349.[PMID: 30262497]
6. Anreiter I et al: New Twists in Detecting mRNA Modification Dynamics. Trends Biotechnol 2021, 39(1):72-89.[PMID: 32620324]
7. Pontier D et al: The m(6)A pathway protects the transcriptome integrity by restricting RNA chimera formation in plants. Life Sci Alliance 2019, 2(3).[PMID: 31142640]
8. Yang X et al: m(6)A promotes R-loop formation to facilitate transcription termination. Cell Res 2019, 29(12):1035-1038.[PMID: 31606733]
9. Hao JD et al: DDX21 mediates co-transcriptional RNA m(6)A modification to promote transcription termination and genome stability. Mol Cell 2024, 84(9):1711-1726 e1711.[PMID: 38569554]

